Faut-il se faire vacciner ? L’ ASMT ne répondra pas à cette question, mais va s’efforcer de répondre à toutes les autres.
Le vaccin est-il sûr ? Sa production n’a-t-elle pas été trop rapide ? Un vaccin ARN, qu’est-ce que c’est ? Y-a-t-il un risque pour ma santé ? Pourquoi injecter un produit dans mon corps pour une maladie dont le taux de mortalité est « si faible ». Autant de questions légitimes pour lesquelles l’ASMT vous propose des éléments de réponse, pour vous permettre de vous construire un avis, oui, mais surtout de le faire en toute connaissance de cause, au regard des connaissances scientifiques sur le sujet.
🧬 Du rôle d’un ARN messager à la balance bénéfice risque de la vaccination, retrouvez ici un résumé de ce qu’on sait et ce qu’on ne sait pas sur ces vaccins à ARN.
📊 Des centaines de millions de personnes dans le monde seront vaccinées en 2021. Avec quelles conséquences ?
🧰 Comme ce n’est pas toujours évident à appréhender vous trouverez ici un outil dont l’objectif est d’aider à visualiser les bénéfices et risques de la vaccination au plan individuel.
🧠 Pour creuser le sujet, quoidansmonassiette propose des tableaux de suivi, et des résumés vulgarisés des publications scientifiques sur le sujet du COVID 19 et des Vaccins.
❓ Une foire au question proposée par la société française de pharmacologie et de thérapeutique. https://sfpt-fr.org/faq-vaccins
La réponse à cette question a fait l'objet d'un consensus d'experts. Le but de la vaccination est « d’imiter » une infection par le virus, en administrant une forme atténuée ou inactivée d’un agent infectieux (ou certains de ses composants) afin de provoquer une réaction du système immunitaire qui produira alors les anticorps nécessaires pour prévenir ou réduire les risques d’infection, de dissémination du pathogène ou encore réduire la dangerosité d’une infection. Références La réponse à cette question a fait l'objet d'un consensus d'experts. Les vaccins sont des médicaments. Leur développement traditionnel est un processus long, nécessitant une moyenne de 15 ans avant la mise sur le marché. La conception du vaccin et son évaluation initiale sont réalisées sur des modèles cellulaires et animaux. Ceci est suivi par des étapes plus formalisées d’exploration de l’efficacité et de la toxicologie sur des modèles animaux en parallèle de travaux sur le processus de fabrication. Pendant ces différentes phases, on étudie l’immunogénicité du vaccin candidat. Une fois ces résultats obtenus, le dossier du vaccin est soumis à une autorité de santé compétente, la Food and Drug Administration aux Etats-Unis, l’European Medicines Agency en Europe avant mise sur le marché. Références La réponse à cette question a fait l'objet d'un consensus d'experts. La pandémie à Sars-Cov-2 a nécessité une réponse beaucoup plus rapide que le schéma traditionnel. Cette accélération a été facilitée par plusieurs facteurs : Références : Le 5 Janvier 2021, selon les données de l'OMS (1) il y avait 236 vaccins candidats en cours de développement dont 63 sont en phase d’évaluation chez l’homme, parmi lesquels 15 sont en phase III, c’est-à-dire au stade de l’évaluation de leur efficacité chez l’homme avant leur mise sur le marché (AMM). A ce jour, deux vaccins à ARN (voir la Q/R06 pour la définition) ont vu leurs résultats d'efficacité et de sécurité publiés: Il s'agit dans les deux cas d'essais randomisés, ayant inclus environ 45 000 (BNT162b2) et 30 000 (mRNA-127) patients, répartis dans deux groupes (vaccin vs. placebo), avec un suivi de 4 mois. Références Les vaccins à ARN (environ 20 % des candidats vaccins) font partie de la famille des vaccins à acide nucléique (voir la réponse 05) Dans ces vaccins, l’information génétique de la protéine « spike » est contenue dans l’ARN. L’ARN étant une molécule instable, il est stabilisé dans des nanoparticules lipidiques* qui permettent également sa pénétration cellulaire et limitent sa dégradation dans la cellule. Cette technologie est récente, mais sert déjà à la conception d’autres vaccins comme celui du virus Zika ou du cytomégalovirus. Le principe est que l’ARN pénètre les cellules humaines et c’est la machinerie cellulaire qui produit la protéine « spike » d’intérêt. L’ARN ne pénètre pas dans le noyau de la cellule, et n’a donc pas la possibilité de s’insérer dans le génome. L’avantage est que l’on ne manipule à aucun moment de virus, et que les données disponibles à ce jour sont rassurantes en termes d’effets indésirables. L’inconvénient est que cela nécessite une gestion des stocks complexes (stockage dans des congélateurs), et que l’on a moins de recul qu’avec les autres types de vaccins. * Une nanoparticule est une structure dont la taille est inférieure à 100 µm. Il existe 3 types de nanoparticules, les inorganiques (métalliques), polymères ou lipidiques. Les vaccins à ARN sont vectorisés par des nanoparticules lipidiques, c.à.d. composées de différents lipides. On utilise principalement des transporteurs lipidiques nanostructurés, mélange de lipides solides et liquides stabilisant le noyau lipidique. Tous les vaccins prochainement mis sur le marché seront administrés par voie intramusculaire. Les rares vaccins développés pour être administrés par voie intranasale ou sublinguale, qui présentent l’avantage de créer une immunité des voies aériennes, sont peu avancés en développement. La réponse à cette question est issue d’un consensus d'experts. L’efficacité d’un vaccin peut-être évaluée par les études cliniques qui comparent le risque relatif de développer la maladie entre une population vaccinée et une population non vaccinée et les études sérologiques reflétant la protection clinique de manière indirecte par la séroconversion après vaccination (deux à six semaines plus tard). A l’heure actuelle il n’existe pas de vaccin connu dont l’efficacité induit une protection à 100%. Les dernières données publiées pour les 3 principaux vaccins en essais cliniques avancés rapportent une efficacité de 95% (Pfizer-BioNtech), 94% (Moderna) et 60 à 90 % (AstraZeneca) contre une infection à la covid-19. Cependant la durée d’efficacité de ces vaccins dans le temps n’est pas encore connue. Il ne s’agit que de résultats préliminaires et c’est pour cette raison que des essais cliniques se poursuivent. Références : Krammer, F. SARS-CoV-2 vaccines in development. Nature 586, 516–527 (2020). https://doi.org/10.1038/s41586-020-2798-3 La réponse à cette question est issue d’un consensus d'experts. On sait pour les personnes âgées que la réponse vaccinale est moins efficace du fait d’un système immunitaire moins actif (immunosénescence), c’est le cas pour le vaccin contre la grippe qui devient moins immunogène. L’efficacité de la réponse vaccinale est également moins longue dans le temps et c’est pourquoi des rappels sont nécessaires de manières plus précoces chez les personnes âgées, c’est le cas pour le vaccin Diphtérie-Tétanos-Poliomyélite. La même question se pose pour les vaccins de la Covid-19, raison pour laquelle les essais cliniques de phase 3 incluent des sujets âgés ou à risque. L’objectif sera surtout de savoir si un type de vaccin doit préférentiellement être administré dans ces populations. Références : La réponse à cette question est issue d’un consensus d'experts. A priori, non. Des vaccins contre un autre virus, le virus respiratoire syncytial, non commercialisés, peuvent aggraver les infections ultérieures lorsque le vacciné développe des anticorps non neutralisants. Pour la Covid-19, les données des premiers essais cliniques ne montrent pas de cas de maladie respiratoire aggravée, en particulier d’aggravation médiée par les anticorps. Ce risque est cependant particulièrement suivi par les autorités de santé avec les vaccins en cours de développement. Références : La réponse à cette question est issue d’un consensus d’experts. Comme pour toute prise de médicament, la vaccination peut entraîner la survenue d'effets indésirables. Quel que soit le vaccin, l’effet indésirable le plus fréquemment rencontré est la douleur au point d’injection, liée à l’administration intramusculaire du vaccin. On retrouve également fréquemment ce qu’on appelle un syndrome pseudo-grippal : fièvre, fatigue, maux de tête, douleurs musculaires. Ce syndrome peut durer quelques jours. Entre les différents types de vaccins contre la Covid-19, il semblerait que les vaccins vivants atténués soient les mieux tolérés, mais sont également les moins immunogènes. Les vaccins à adénovirus et à ARN entraînent quant à eux plus souvent une douleur au point d’injection et de la fièvre. C’est pour cette raison que leur administration peut s’accompagner d’une prise de paracétamol par voie orale. La réponse à cette question est issue d’un consensus d’experts. Il semble important de rappeler que comme pour tout médicament, la sécurité d’emploi d’un vaccin fait partie intégrante de chacune des étapes de son développement, au même titre que l’évaluation de son efficacité. D’ailleurs, cette considération implique généralement d’inclure suffisamment de personnes dans les essais cliniques, et de les suivre sur une durée suffisante pour s’assurer d’objectiver un profil de tolérance représentatif, et de pouvoir mettre en évidence les effets indésirables moins fréquents et inattendus. Une fois sur le marché, la surveillance du médicament, du vaccin, ne s’arrête pas : c’est ce qu’on appelle la phase IV du développement, où intervient la pharmacovigilance. En effet, dans des conditions d’utilisation “en vie réelle”, sur une plus large population que dans le cadre des essais cliniques, des effets rares, complexes (liés au terrain du patient ou à des interactions médicamenteuses par exemple), ou tardifs peuvent être mis en évidence. Tout l’enjeu de la pharmacovigilance est donc de garantir que la balance “bénéfices-risques” du médicament, du vaccin, reste positive dans ses conditions d’utilisation dans la population, et ce durant toute la vie du vaccin. En cas de mise en évidence d'un nouveau risque, des mesures de minimisation des risques peuvent être mises en place. Par exemple, si on se rend compte qu’une population définie est plus à risque de faire un effet indésirable particulier avec un vaccin précis, on pourra contre-indiquer ce vaccin à cette population, et on lui recommandera plutôt un autre vaccin qui n’est pas à risque de provoquer cet effet indésirable. Ainsi, en France, la sécurité des vaccins de la Covid-19 commercialisés fait l’objet: d’une part, d’un suivi en pharmacovigilance, via les Centres Régionaux de Pharmacovigilance (CRPV), et d’autre part du suivi systématique d’une cohorte de patients. Tous deux sont sous la responsabilité de l’Agence Nationale de Sécurité du Médicament et des Produits de Santé (ANSM). Pour permettre aux CRPV de détecter des signaux, il faut que les effets indésirables soient déclarés. Cette déclaration peut être faite par les professionnels de santé ou par les patients eux-mêmes. Afin d’aider les CRPV dans leur mission, des moyens humains supplémentaires ont été demandés. Mais ce n’est pas la seule aide dont ils vont disposer. Pour des informations détaillées sur la procédure de suivi, voir la QR13 La réponse à cette question est issue d’un consensus d’experts. Les déclarations d’effets indésirables liés aux vaccins contre la COVID-19 gérées par les CRPV puis enregistrées dans la base française de pharmacovigilance et les déclarations enregistrées par les firmes commercialisant les vaccins seront analysées dans le cadre d’une enquête de pharmacovigilance mise en place par l’ANSM et confiée à des CRPV experts, nommés par l’ANSM. Ils sont au nombre de 2 par vaccin. Pour le vaccin Comirnaty® (BNT162b2), il s'agit des centres de Bordeaux et Marseille Ce travail de synthèse permettra d’avoir une analyse globale afin de détecter de nouveaux signaux potentiels de sécurité : nouveaux effets, gravité inattendue, facteurs de risques potentiels… L’ensemble de éléments analysés permettra de prendre des mesures de minimisation du risque adaptées, d’alerter, le cas échéant, l’EMA, les professionnels de santé et les patients et permettra également au Ministère chargé de la Santé d’adapter la stratégie de vaccination, si nécessaire. Chaque semaine, l’ANSM publiera sur son site Internet les données de pharmacovigilance et les faits marquants, comme cela est fait pour l’enquête sur les médicaments utilisés dans la COVID-19 depuis mars 2020. Pour en savoir plus, consultez le site du réseau français des CRPV Le développement des vaccins de la Covid-19 a utilisé toutes les technologies connues, parmi lesquelles on peut différencier 2 approches (figure) : l’utilisation de tout ou partie du virus, ou l’utilisation de son code génétique. Ceci explique qu’une grande variété de vaccins technologiquement très différents sont développés : Ceci consiste à cultiver le virus Sars-Cov-2 sur des cellules puis de l’inactiver (c’est une technique traditionnelle que l’on retrouve pour le vaccin de la poliomyélite ou de la grippe) avant de l’injecter. Ces vaccins sont administrés par voie intramusculaire et peuvent nécessiter un adjuvant pour stimuler la réponse immunitaire. Ceci consiste à injecter un virus Sars-Cov-2 dont la virulence est atténuée. L’avantage est que ces vaccins peuvent être administrés par voie nasale et procurer une protection des voies aériennes supérieures et donc protéger de l’infestation, et d’induire une forte réponse immunitaire sans adjuvant (historiquement, c’est par exemple le vaccin contre la rougeole). Par contre, l’énorme inconvénient est qu’il faut contrôler la virulence du vaccin, au risque de transmettre une maladie. Ces vaccins sont donc contre indiqués chez les patients immunodéprimés Il n’y a aujourd’hui que 3 vaccins de ce type en cours de développement. Appelés également vaccins à protéines recombinantes (c’est par exemple le virus contre l’hépatite B). Il s’agit d’injecter une partie du virus impliquée dans l’adhésion aux cellules humaines. Ces vaccins se différencient en 3 sous catégories : L’avantage de ces vaccins est que leur processus de fabrication est connu et ne nécessite pas de virus vivant. Les inconvénients sont que cette technologie ne permet pas facilement de produire de grandes quantités de vaccins, et que leur immunogénicité modeste requiert la présence d’adjuvant pour stimuler le système immunitaire. Ces vaccins consistent en l’utilisation d’un autre virus modifié pour exprimer la protéine « spike » pouvant infecter les cellules mais pas se multiplier. Ils sont principalement à base d’adénovirus, un virus connu, stable. L’avantage est que l’on ne manipule pas de virus Sars-Cov-2, que le processus de fabrication est connu (c’est le principe du vaccin contre le virus de l’Ebola). L’inconvénient potentiel est que l’on peut avoir une immunité préalable contre le virus vecteur, ou la créer avant la seconde injection du vaccin. La version à vecteurs répliquant est moins avancée en recherche clinique et permet théoriquement une meilleure immunité. Il existe aussi quelques vaccins à vecteurs viraux inactivés (n’entrant pas dans les cellules et ne se multipliant pas). Il s’agit d’une nouvelle famille de vaccins. Aucun vaccin n’est commercialisé avec cette technique, mais leur développement est antérieur à la pandémie covid-19 : La réponse à cette question est issue de la stratégie vaccinale annoncée par le gouvernement le 07 janvier 2021 faisant suite aux recommandations préliminaires publiées par l’HAS le 30 novembre 2020 et précisées le 18 décembre 2020. Elles décrivent 3 phases suivant l’approvisionnement progressif en vaccins et des ordres de priorité prenant en compte 2 critères principaux : Elles précisent également les personnes non inclues dans les populations à vacciner en priorité : les femmes enceintes et les personnes ayant déjà eu la Covid-19 sous forme symptomatique (pas de vaccination systématique mais possibilité après décision partagée avec le médecin en respectant un délai minimal de 3 mois à partir du début des symptômes). Par ailleurs, à ce jour, la HAS recommande de ne pas tenir compte d’une éventuelle préalable sérologie positive ou négative pour décider de la vaccination. A l'heure actuelle, la campagne utilise deux vaccins à ARN: le BNT162b2 de BioNTech - Pfizer (Comirnaty), et le Moderna COVID-19 mRNA (https://www.has-sante.fr/jcms/p_3230294/fr/vaccination-contre-la-covid-19-la-has-inclut-le-vaccin-de-moderna-dans-la-strategie-vaccinale) . Le choix entre les deux vaccins repose pour le moment sur la disponibilité des doses et sur les contraintes logistiques (au 11 janvier, le vaccin Moderna est livré en priorité dans 4 régions). Par ailleurs, en l’état actuel des connaissances, la HAS recommande d’administrer le même vaccin en première et seconde dose. Références : Le jour de votre rendez-vous, vous devrez venir avec votre pièce d’identité et votre carte vitale. Vous bénéficierez d’une consultation pré vaccinale au centre de vaccination pour s’assurer de l’absence de contre-indication ou de la nécessité de précautions d’emploi. Durant cette consultation, vous aurez à répondre aux questions suivantes: Etape de vaccination. A savoir : la vaccination est prise en charge à 100% par l’Assurance maladie. La réponse à cette question est issue d’un consensus d’experts. L’objectif de la vaccination est, bien entendu, de protéger l’individu vacciné, mais également de protéger l’ensemble de la population dans laquelle circule le virus. On appelle cela, l’immunité collective. L’immunité collective est définie comme le seuil de protection de la population à partir duquel un individu infecté dans cette population pourrait contaminer moins d’une personne, ce qui, à terme, permettrait d’éliminer le virus de cette population. La protection de la population peut être obtenue par immunité naturelle (les patients infectés ont survécu et ont développé des anticorps contre l’agent infectieux), ou par la vaccination (les personnes ont développé des anticorps grâce au vaccin). Ensuite, le seuil à atteindre pour bénéficier de cette immunité collective dépend de la maladie et, d’en autre, de sa contagiosité. A titre d’exemple, il faut au moins 95% de la population vaccinée contre la Rougeole pour nous en protéger collectivement. Compte-tenu des conséquences sanitaires de la pandémie de la Covid-19, il est éthiquement inconcevable de ne compter que sur l’immunité naturelle pour obtenir une immunité collective. De plus, dans la plupart des pays du monde, on estime que moins de 10% de la population a été infectée par le virus de la COVID-19. Ainsi, il est plus que nécessaire de vacciner le plus largement possible, afin d’atteindre rapidement ce seuil de protection collective. A ce jour, ce seuil pour la Covid-19, n’est pas encore établi avec certitude, car il dépend de multiples facteurs, mais d’après l’Institut Pasteur, il devrait se situer autour des 70%. Une fois un vaccin efficace et sûr obtenu, il faut encore pouvoir être en capacité de vacciner le plus largement possible, et le plus justement possible. Ainsi, depuis le mois de mai 2020, l’OMS a mis en place l’ACT ACCELERATOR, permettant d'accélérer les recherches et la mise à dispositions entre autres des vaccins et de façon équitable dans le monde. A l’échelle nationale, la Haute Autorité de Santé a émis des recommandations quant à l’ordre dans lequel la population française pourra être vaccinée. La vaccination en France devra donc commencer par les résidents d’EHPAD et les professionnels de santé en première ligne face à la COVID-19. L’ordre prévisionnel de vaccination complet est disponible ici : https://www.has-sante.fr/jcms/p_3221237/fr/vaccins-covid-19-quelle-strategie-de-priorisation-a-l-initiation-de-la-campagne Références : La réponse à cette question a fait l'objet d'un consensus d'experts. L’injection des vaccins contre la COVID-19 est réalisée par une voie intramusculaire, le plus souvent au niveau de l’épaule (muscle deltoïde). L’ARNm injecté entre alors dans le cytoplasme des cellules présentes localement. Il est ensuite traduit en protéines ‘spicules, exprimées à la surface cellulaire/des virus. Ces protéines sont ensuite prises en charge par des cellules particulières du système immunitaire, appelées cellules présentatrices de l’antigène. Ces cellules sont les principales cellules dans lesquelles on retrouve ensuite l’ARN et la protéine. Ces cellules vont ensuite migrer dans les ganglions lymphatiques. L’ARN n’est ensuite plus détectable au bout de 3 jours. Références 1- Comment fonctionne un vaccin ?
Cette défense face à une infection ultérieure est maintenue par la persistance de cellules immunitaires mémoires (Lymphocytes B, Lymphocytes T CD4/CD8) produit au décours de la vaccination.
Suite à une nouvelle rencontre avec l’agent infectieux, des cellules, qu’on appelle cellules présentatrices de l’antigène vont capter cet agent infectieux afin de le présenter, via des antigènes (protéines présentes sur la face externe donc visible par le système immunitaire ou des toxines du pathogène), aux cellules immunitaires mémoires permettant une réponse rapide (3 à 5 jours) médier par des lymphocytes T CD8 dit tueurs, et des lymphocytes B producteurs d’anticorps en autre.
Dans le cadre du SARS CoV-2 la protéine la plus « visée » par les candidats vaccins est la protéine S (Spicule), protéine responsable de l’infection des cellules par le virus.
2 - Comment développe-t-on les vaccins en général ?
Les étapes pré-cliniques :
Les étapes cliniques :
On voit donc que ce processus est long, complexe, et il fait l’objet d’une évaluation économique à chaque étape.
Krammer, F. SARS-CoV-2 vaccines in development. Nature 586, 516–527 (2020). https://doi.org/10.1038/s41586-020-2798-3 3 - Comment expliquer que l'on mette si peu de temps pour développer les vaccins de la COVID-19 ? Sont-ils des vaccins conçus trop vite ?
Krammer, F. SARS-CoV-2 vaccines in development. Nature 586, 516–527 (2020). https://doi.org/10.1038/s41586-020-2798-3 4 - Combien de vaccins de la Covid-19 sont en développement aujourd’hui ? quels sont les résultats des études cliniques?
5 - Qu'est-ce qu'un vaccin à ARN?
6 - Par quelle voie vont être administrés les vaccins de la Covid ?
7 - Le vaccin de la Covid va-t-il me protéger à 100 % ?
![]() Non, les vaccins injectés par voie intramusculaire n'éviteront que partiellement l’infection. Ils limiteront la réplication du virus et la progression vers des formes sévères de la Covid-19. C’est déjà le cas avec le vaccin de la grippe saisonnière qui diminue seulement de 50% l’infection mais protège des formes graves. Pour la Covid-19, la diminution des formes graves et de la réplication virale va diminuer la contagiosité.
Non, les vaccins injectés par voie intramusculaire n'éviteront que partiellement l’infection. Ils limiteront la réplication du virus et la progression vers des formes sévères de la Covid-19. C’est déjà le cas avec le vaccin de la grippe saisonnière qui diminue seulement de 50% l’infection mais protège des formes graves. Pour la Covid-19, la diminution des formes graves et de la réplication virale va diminuer la contagiosité.
Flanagan KL, Best E, Crawford NW, Giles M, Koirala A, Macartney K, Russell F, Teh BW and Wen SCH (2020) Progress and Pitfalls in the Quest for Effective SARS-CoV-2 (COVID-19) Vaccines. Front. Immunol. 11:579250. https://doi.org/10.3389/fimmu.2020.579250
P. Polack et al., Safety and Efficacy of the BNT162b2 mRNA Covid-19 Vaccine. New England Journal of medicine; December 10, 2020 https://doi.org/10.1056/NEJMoa2034577
M Voysey et al., Safety and efficacy of the ChAdOx1 nCoV-19 vaccine (AZD1222) against SARS-CoV-2: an interim analysis of four randomised controlled trials in Brazil, South Africa, and the UK. https://doi.org/10.1016/ S0140-6736(20)32661-1. The Lancet. December 8, 2020. https://doi.org/10.1016/s0140-6736(20)32466-1 8 - Les sujets âgés seront-ils protégés de la même façon par le vaccin ?
9 - Les vaccins pourraient-ils aggraver la Covid-19 ?
10 - A quels effets indésirables dois-je m’attendre ? Sont-ils les mêmes pour tous les vaccins ?
Concernant les vaccins utilisés ou en voie d'utilisation dans la Covid-19, en particulier les vaccins à ARN (NT162b2 - Comirnaty® de BioNTech - Pfizer et mRNA-1273 de Moderna) , les données actuelles sont rassurantes :
Références :
11 - Comment va-t-on vérifier que les vaccins de la Covid-19 sont sûrs ?
Avant la mise sur le marché (AMM)
Ce n’est qu’à la condition d’une balance “bénéfices-risques” favorable, établie sur les critères d’efficacité et de sécurité, qu’un vaccin, ou tout autre médicament, peut obtenir son autorisation de mise sur le marché (AMM).
Toutefois, compte tenu du relativement faible nombre de personnes incluses dans les essais cliniques et de la durée courte du suivi, seuls les effets les plus fréquents et de survenue précoce sont susceptibles d’être détectés (par exemple, si l’étude a inclus 10 000 personnes, un effet qui surviendrait chez 1 patient sur 100 000 n’a que très peu de chance de survenir).Une fois l’AMM obtenue
![]() Pour en savoir plus sur la pharmacovigilance : reportez-vous à la question #153.
Pour en savoir plus sur la pharmacovigilance : reportez-vous à la question #153.
Le suivi de pharmacovigilance en France s’intègre dans le plan de gestion des risques coordonné par l’Agence Européenne du Médicament (EMA). De plus, la sécurité sera surveillée au niveau mondial par l’Organisation Mondiale de la Santé (OMS) qui centralise le suivi à Uppsala, en Suède.En pratique, pour les vaccins de la COVID-19
Attention : l’objectif n’est pas de faire une revue exhaustive des effets indésirables bénins déjà connus et étudiés dans le cadre des essais cliniques, mais de mettre en évidences des effets indésirables graves et/ou nouveaux, ayant conduit à une consultation médicale ou à une hospitalisation.
Ainsi, il n’est pas pertinent voire même contre-productif de déclarer la survenue d’effets connus et bénins, comme la survenue d’une fièvre modérée, ou de maux de têtes par exemple. Ceci risquerait d’engorger le système et de retarder la détection d'effets indésirables graves ou nouveaux.
![]() Le 24/12/2020, l'ANSM a publié un point d'information sur le dispositif de surveillance renforcée des vaccins.
Le 24/12/2020, l'ANSM a publié un point d'information sur le dispositif de surveillance renforcée des vaccins.Il comprend en particulier des guides de déclaration pour les patients et pour les professionnels de santé, ainsi qu'une fiche récapitulant les effets indésirables pouvant survenir après la vaccination
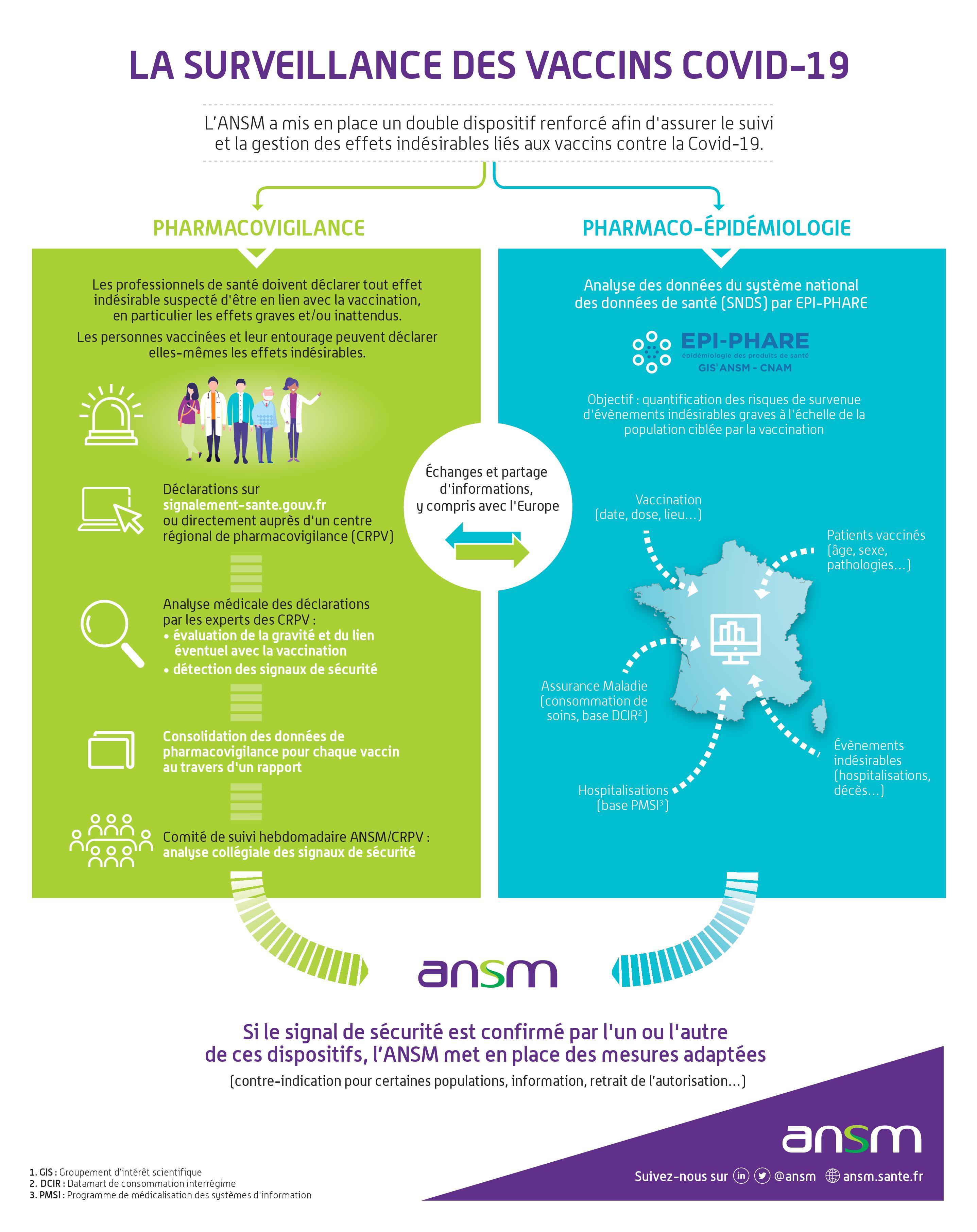
A partir de la mi-janvier, un système d’intelligence artificielle va être déployé. L’objectif ne sera pas de remplacer l’expertise humaine mais de fluidifier la chaine d’analyse. En effet, l’intelligence artificielle interviendra entre la déclaration des patients via le portail de signalement des événements sanitaires indésirables https://signalement.social-sante.gouv.fr/ et l’expertise des pharmacovigilants des CRPV (les déclarations provenant des médecins seront analysées en priorité sans passer par ce système).
L’intelligence artificielle va dans un premier temps transformer les verbatims contenus dans les déclarations des patients en termes médicaux selon la classification MedDRA utilisée dans les CRPV. Ensuite, elle analysera ces termes pour trier les déclarations « graves » et « non graves », sans juger du rôle qu’a joué le vaccin dans la survenue de l’effet. Ceci va permettre aux pharmacovigilants des CRPV de prioriser leurs analyses, et ainsi d’être plus réactifs dans la mise en évidence de signaux.
Les déclarations non urgentes seront traitées dans un deuxième temps.
Pour information, l’intelligence artificielle stockera uniquement les données anonymisées, et le logiciel est régit par le cahier des charges de l’ANSM en termes de sécurités des données.Références :
12 - En pratique, comment va se dérouler le suivi des effets indésirables des vaccins COVID?
L’objectif est de détecter des effets nouveaux et/ou graves qui peuvent être des signaux de sécurité, non identifiés dans les essais cliniques. Cette détection doit se faire en temps réel et s’appuie sur le principe de la notification spontanée des effets indésirables par les acteurs du système de soins, professionnels de santé et patients.
Ces analyses feront l’objet d’un rapport hebdomadaire par les CRPV experts qui sera discuté au sein d’un comité de suivi constitué par l’ANSM. Ce comité réunit des membres de l’ANSM et des représentants des CRPV. D’autres données seront également discutées afin de croiser les signaux : essais cliniques, veille documentaire scientifique et veille statistique de la base nationale de pharmacovigilance.
Il est également prévu des études de pharmacoépidémiologie basées sur les données du Système National des Données de Santé (SNDS). Ces études permettront également, si nécessaire, d’explorer des signaux identifiés par la pharmacovigilance.
Par ailleurs, en cas d’un signal détecté en France, ou à l’international, susceptible de conduire à une réévaluation du rapport bénéfice-risques des vaccins, les autorités compétentes des Etats membres de la communauté européenne s’informeront mutuellement afin de prendre des dispositions concertées.
Enfin, au cours de la première phase de vaccination, au niveau de chaque région, les CRPV seront en contact direct avec les établissements hébergeant des personnes âgées afin de recueillir les effets indésirables potentiels des vaccins. 13 - Quel est le panorama des vaccins de la Covid-19 ? Pourquoi y a-t-il autant de vaccins en cours de développement ?
![]() Les vaccins inactivés.
Les vaccins inactivés.![]() Les vaccins vivants atténués.
Les vaccins vivants atténués.![]() Les vaccins à sous-unité protéique (environ 33% des candidats vaccins)
Les vaccins à sous-unité protéique (environ 33% des candidats vaccins)
![]() Les vaccins à vecteurs viraux non répliquant (environ 25% des candidats vaccins).
Les vaccins à vecteurs viraux non répliquant (environ 25% des candidats vaccins).![]() Les vaccins à acide nucléique :
Les vaccins à acide nucléique :
14 - Quand pourrais-je être vacciné(e) ?
1ère phase
![]() Cette phase a débuté en France le 27 décembre (en utilisant le vaccin BNT162b2 de BioNTech - Pfizer), et s’étalera sur janvier 2021, elle concerne environ 1 million de personnes
Cette phase a débuté en France le 27 décembre (en utilisant le vaccin BNT162b2 de BioNTech - Pfizer), et s’étalera sur janvier 2021, elle concerne environ 1 million de personnes
2ème phase
![]() Cette phase a débuté et se poursuivra jusqu’au printemps 2021 :
Cette phase a débuté et se poursuivra jusqu’au printemps 2021 :
- Atteints de cancers et de maladies hématologiques malignes en cours de traitement par chimiothérapie ;
- Atteints de maladies rénales chroniques sévères, dont les patients dialysés ;
- Transplantés d’organes solides ; Transplantés par allogreffe de cellules souches hématopoïétiques ;
- Atteints de poly-pathologies chroniques et présentant au moins deux insuffisances d’organes ;
- Atteints de certaines maladies rares et particulièrement à risque en cas d’infection (liste spécifique établie par le COS et les filières de santé maladies
- Atteints de trisomie 21.3ème phase
![]() à partir du printemps 2021 : généralisation de la vaccination à l’ensemble de la population suivant l’ordre de priorisation suivant en fonction de l’approvisionnement en vaccin
à partir du printemps 2021 : généralisation de la vaccination à l’ensemble de la population suivant l’ordre de priorisation suivant en fonction de l’approvisionnement en vaccin
15 - Comment se déroule la vaccination contre la COVID-19 en pratique ?
![]() Il est nécessaire de prendre rendez-vous auprès d’un centre de vaccination près de chez vous (se référer à l’item 14 de cette FAQ pour s’assurer d’être dans la population éligible à la vaccination). Voir ce site pour trouver un lieu de vaccination : https://sante.fr/carte-vaccination-covid
Il est nécessaire de prendre rendez-vous auprès d’un centre de vaccination près de chez vous (se référer à l’item 14 de cette FAQ pour s’assurer d’être dans la population éligible à la vaccination). Voir ce site pour trouver un lieu de vaccination : https://sante.fr/carte-vaccination-covid
En cas d’antécédents de réactions grave de type anaphylactique (réaction allergique immédiate et généralisée comprenant des atteintes respiratoires, digestives, etc.), la vaccination n’est pas recommandée. De même la 2ème dose du vaccin n’est pas recommandée en cas de réaction anaphylactique suite à la 1ère dose.
Les molécules PEG (polyéthylène glycol) sont largement utilisées dans la composition de médicaments : on les retrouve comme laxatif (macrogol), mais également dans la composition de médicaments administrés par voie injectable pour augmenter leur durée de vie (facteurs de croissance hématopoïétique, anti-cancéreux, etc.). Ces molécules rentrent dans la composition du vaccins ARNm, et pourraient être impliquées dans les réactions anaphylactiques observées très rares (environ 1/100 000 vaccinations - voir QR 11 de cette FAQ).
Au vu du manque de données, l’administration du vaccin pendant la grossesse ou l’allaitement, n’est pas recommandé pour le moment. Elle sera toutefois à discuter si un risque de forme grave existe du fait de certaines comorbidités.
Les traitements anticoagulants, les thrombopénies ou les troubles de la coagulation ne sont pas une contre-indication stricte à la vaccination par voie intra musculaire. La prudence est requise en raison d’un risque de saignement ou d’ecchymose, il est recommandé d’utiliser une aiguille fine, suivie d’une compression forte et prolongée (2 minutes). Toutefois, dans les cas de troubles sévères, il est nécessaire de se référer à son médecin afin d’évaluer les bénéfices/risques de la vaccination.
Il est nécessaire de respecter un délai minimal de 3 mois depuis l’apparition de symptômes au cours de l’affection COVID-19. Il n’est pas utile de réaliser de sérologie, car elle ne permet pas d’identifier les personnes potentiellement protégées contre le virus.
Si oui, comme pour tous vaccins, la vaccination doit être reportée.
Dans le cas où vous êtes cas contact, il est nécessaire de réaliser un test de dépistage. La vaccination pourra être envisagée si le ou les tests s’avèrent négatifs.
Il est recommandé un intervalle minimum de 14 jours avant ou après toute autre vaccination. Il n’est pas conseillé de faire un autre vaccin dans l’intervalle de temps séparant les deux doses de la vaccination contre la COVID-19.
Références
16 - Pourquoi faut-il vacciner une large proportion de la population ?
![]() L’immunité collective
L’immunité collective![]() La faisabilité
La faisabilité 17 - Je suis sous un traitement pour une pathologie chronique, puis-je me faire vacciner contre la COVID-19 ?
Oui, à l’heure actuelle la vaccination contre la COVID-19 est recommandée chez des patients sous traitements chroniques. Il n’a pas été observé au cours des essais de phase III de différences d’efficacité ou de tolérance chez les patients ayant un/des traitement(s) chronique(s).
Les facteurs de risques individuels de développer une forme grave de la maladie (personne âgée, obésité, BPCO et insuffisance respiratoire, hypertension artérielle compliquée, insuffisance cardiaque, diabète de type 1 et 2, insuffisance rénale chronique, cancers récents de moins de trois ans, transplantation d’organe solide et de cellules souches hématopoïétiques et trisomie 21) sont un critère de priorisation de la vaccination.
Concernant les traitements immunosuppresseurs, les patients sous traitements immunosuppresseurs n’ont pas été inclus dans les essais de phase III des vaccins commercialisés à ce jour. Toutefois les vaccins à ARN présentent l’avantage d’absence de manipulation du virus contrairement aux vaccins vivants atténués qui sont eux contre-indiqués chez les patients immunodéprimés. 18 - Dans quelles cellules retrouve-t-on les ARNm contenus dans le vaccin après l’injection ?
Lindsay, K.E., Bhosle, S.M., Zurla, C. et al. Visualization of early events in mRNA vaccine delivery in non-human primates via PET–CT and near-infrared imaging. Nat Biomed Eng 3, 371–380 (2019). https://doi.org/10.1038/s41551-019-0378-3
Zhang NN, et al. A Thermostable mRNA Vaccine against COVID-19. Cell. 2020 Sep 3;182(5):1271-1283.e16. doi: https://doi.org/10.1016/j.cell.2020.07.024



